QUIMICA
👆👆👆SEGUNDO PERIODO👆👆👆
=======================================================================================
GUIA # 3 PERIODO 1
|
GUÍA DE APRENDIZAJE N° 3 –
PRIMER PERIODO |
|
|
Área: Ciencias Naturales
Asignatura: Química
Grado: 10 Año: 2021 Docente: María Angélica Trespalacio Grupos: 10-01, 10-02,
10-03, 10-04 Fecha de Inicio: Marzo 22 de 2021
Fecha Máxima de devolución: Abril 16 de 2021 |
|
|
Medio
de entrega |
Deben enviar
las fotos de las actividades y/o vídeos
al WhatsApp del docente de
química. Docente:
María Angélica Trespalacio WhatsApp: 304 572 60 74 |
|
|
|
|
Tiempo |
Esta
guía está diseñada para que la realices en 3 semanas, dedicando 4 horas a la semana |
|
Instrucciones
para desarrollar la actividad |
Primero:
Dedica un tiempo mínimo de una hora cada semana a los saberes previos para su
asimilación. Segundo:
Dedica un tiempo mínimo de una hora cada semana a la estructuración para su
comprensión. Tercero:
Dedica
un tiempo mínimo de 2 horas semanalmente a la transferencia para su
desarrollo. Cuarto: Sí,
tienes dudas o inquietudes en la estructuración o en las actividades, consulta al docente comunicándote vía telefónica o
WhatsApp al 3045726074, email mtrespalacio21@hotmail.com o
comunicación semanal a través
de la clase virtual o video llamada. |
|
Recomendaciones |
Las actividades se deben realizar en el cuaderno de
química. Al comienzo de cada
actividad de transferencia debe tener el siguiente encabezado: Nombre completo del
estudiante, tema de la actividad, curso, periodo y nombre del docente al que
le envía. Si las actividades que envías no tienen el encabezado, la actividad
será devuelta. Enumera secuencialmente cada hoja de la actividad En los videos que
debas enviar debes de salir con el uniforme de diario de la institución |
|
Productos
a entregar por el estudiante |
Fotos de las
actividades y/o vídeos realizados |
|
Hora
de comunicación semanal con el docente |
Docente: María Angélica Trespalacio Grupo 10-01
Viernes Hora: 7:00
A.M a 9:00 A.M Grupo 10-02 Viernes Hora: 10: 00 A.M a 12:00 A.. Grupo 10-03 Jueves Hora: 7:00 A.M a 9:00 A.M Grupo 10-04 Lunes Hora:
7:00 A.M a 9:00 A.M |
Primera Semana: TEMA 1:
DIA MUNDIAL DEL AGUA
a Asamblea General de las Naciones Unidas adoptó en diciembre de 1992 la resolución por la que el 22 de Marzo de cada año fue declarado Día Mundial del Agua, a celebrarse a partir de 1993, de acuerdo con las recomendaciones de la conferencia de la Naciones Unidas sobre medio ambiente y desarrollo contenidas en el capítulo titulado “Recursos de Agua Dulce” de la agenda 21.
Según voceros de esta organización, este año, el Día Mundial del Agua tiene un significado especial, en el 2005 se estableció que este día giraría en torno a la conservación y cuidado, teniendo como lema “El agua, fuente de vida”, pero cada año la consigna que abandera las estrategias para concienciar al mundo, varían, para este año la ONU le apuntó a un mensaje claro y conciso, “No dejar atrás a nadie”, una adaptación de la promesa central de la Agenda 2030 para el Desarrollo Sostenible.
ACTIVIDAD # 1
1. Realice una
lista de importancia del agua para tu población.
2. Desde tu punto de vista explica las problemáticas que
afronta el agua en la región.
3. Plantea soluciones a esta problemática.
4. Teniendo
en cuenta las problemáticas que señaló anteriormente diseña una noticia y
preséntala escrita, audio o video.
Tema 2: CONFIGURACIÓN ELECTRÓNICA
Aprenderás…
La configuración electrónica
Qué se te viene
a la mente cuando escuchas el término configuración electrónica?
¿Sabías que la
configuración electrónica nos ayuda a determinar el grupo y el periodo de los
elementos en la tabla periódica?
CONFIGURACIÓN ELECTRÓNICA
La organización de los electrones dentro del átomo requiere
de una serie de reglas básicas que responden a los “principios de la Teoría
Cuántica” y queda representados por la Configuración Electrónica. La
configuración electrónica de un átomo se entiende como “La distribución de los
electrones en los diferentes niveles y orbitales de un átomo”.
¿Cómo se escribe la configuración electrónica?
Para
describir la configuración electrónica de un átomo es necesario:
➔ Saber
el número de electrones que el átomo tiene, es decir el número atómico (Z)
§ EL NUMERO ATOMICO (Z): representa el número de protones (p+) y como el átomo es neutro, los protones son igual que los electrones (p+ = e-) La representación de los electrones se da en niveles y orbitales de energía en la configuración electrónica así:
Nota: existen 7 niveles que están representados a través de
los números del 1 al 7 y 4 subniveles que los representan las letras s, p; d y f, que aceptan cada uno un máximo de electrones, así: s acepta máximo 2 electrones, p
acepta 6 electrones máximo, d acepta máximo 10 y f hasta 14.
Veamos un ejemplo: Configuración
electrónica del CLORO (17 Cl):
Debemos dar la distribución electrónica para el elemento
CLORO, que como su número atómico indica tiene 17 electrones. Para realizar la distribución nos apoyamos en
la tabla de arriba que nos muestra la “regla de las diagonales”, según la
dirección que indica los niveles y subniveles se llenan así:
✔En el
Nivel 1, dos
electrones en el subnivel s= 1s2
✔ En el nivel 2, los dos
electrones en el subnivel s = 2s2
✔ Pasamos
a la otra línea y nos encontramos con el mismo nivel 2 pero con el subnivel p, en el que caben 6 electrones = 2p6
✔ Seguimos bajando hacia el nivel 3 con subnivel s, que caben 2 electrones =
3s2
✔ Saltamos
a la siguiente línea diagonal y encontramos el mismo nivel 3 con subnivel p= 3p5 se agrega 5 que son
los que faltan para completar 17. La distribución que así:
Para hacer la distribución por orbitales hay que tener en cuenta que cada subnivel de energía tiene un número definido de orbitales, los cuales se representan por cuadros o círculos, y alojan máximo 2 electrones, que se representan con flechas. La siguiente tabla resume el subnivel y el número de orbitales:
Si distribuimos por diagrama de orbitales los electrones del cloro tenemos:
v TRANSFERENCIA
ACTIVIDAD # 2
1. Elabora la distribución electrónica de los siguientes elementos:
a) Calcio, Ca: Z = 20.
b) Potasio, K: Z = 19.
c) Azufre, S: Z = 16.
d) Hierro, Fe: Z = 26.
e) As, Z = 33
f) Zn, Z = 30
g) Si, Z = 14
h) Ni, Z = 28
2. Selecciona 5 elementos del punto anterior y realiza para cada uno la
distribución por orbitales.
3. Consulta los siguientes números cuánticos y Completa el siguiente
cuadro:
Segunda Semana: Tema: CONFIGURACIÓN ELECTRÓNICA Y LA TABLA PERIÓDICA
Con
la configuración electrónica, podemos predecir exactamente el número atómico,
el grupo y el periodo en que se encuentra el elemento dado.
v ¿Cómo se hallas el número atómico?
Realizando
la suma total de los electrones. Recordemos que los electrones son los números
a lo que están elevados los subniveles s,
p, d, f
v
¿Cómo se halla el periodo? Observando y
teniendo en cuenta el máximo nivel de energía de la configuración, los niveles
de energía son los que van de 1 a 7.
v
¿Cómo se halla el grupo? Sumando los
electrones en los últimos subniveles de energía. Ejemplos: Si la configuración electrónica termina en “d” se suman
los e- de “d” y la “s” anterior para hallar el grupo.
Ejemplo
Z = 25 Manganeso
Mn: 1s2
2s2 2p6 3s2 3p6 3d5 4s2
Se
suman 5 y 2 que son los electrones que están en 3d5 4s2
esto quiere decir que el manganeso está en el Grupo 7B.
*
Si la configuración electrónica termina en “p” se suman los e- de “p” y los de
la “s”, para hallar el grupo.
Z = 15 Fósforo
P: 1s2
2s2 2p6 3s2 3p3
Se
suman 2 y 3 que son los electrones que están en 3s2 3p3
esto quiere decir que el manganeso está en el Grupo 5B.
Para saber si el grupo es B o A, lo
determinamos en la tabla periódica según su ubicación.
v TRANSFERENCIA
ACTIVIDAD # 3
1. Con ayuda de la información anterior, realice la configuración
electrónica de los siguientes elementos, colocando el nombre y el símbolo del elemento,
hallando masa atómica, y dando la ubicación del grupo y el periodo.
|
Z=17, |
Z=35, |
Z=24, |
Z=76, |
|
Z=45, |
Z=63, |
Z=28, |
Z=56, |
|
Z=44, |
Z=28, |
Z=9, |
Z=36, |
2. Completa la información de la siguiente tabla:
3. ¿Qué información aporta la configuración electrónica en relación con
las propiedades de las sustancias?
Tercera Semana Tema: LA BIIOTECNOLOGÍA
Aprenderás…
La utilización de las nuevas tecnologías en las ciencias naturales
¿Qué has escuchado acerca de la biotecnología?
v LA BIOTECNOLOGÍA
La biotecnología no es, en sí
misma, una ciencia; es un enfoque multidisciplinario que involucra varias
disciplinas y ciencias (biología, bioquímica, genética, virología, agronomía,
ingeniería, química, medicina y veterinaria entre otras).
Hay muchas
definiciones para describir la biotecnología. En términos generales biotecnología
es el uso de organismos vivos o de compuestos obtenidos de organismos vivos
para obtener productos de valor para el hombre.
Como tal, la
biotecnología ha sido utilizada por el hombre desde los comienzos de la
historia en actividades tales como la preparación del pan y de bebidas
alcohólicas o el mejoramiento de cultivos y de animales domésticos.
Históricamente, biotecnología implicaba el uso de organismos para realizar una
tarea o función. Si se acepta esta definición, la biotecnología ha estado presente
por mucho tiempo. Procesos como la producción de cerveza, vino, queso y yogurt
implican el uso de bacterias o levaduras con el fin de convertir un producto
natural como leche o jugo de uvas, en un producto de fermentación más
apetecible como el yogurt o el vino.
Tradicionalmente
la biotecnología tiene muchas aplicaciones. Un ejemplo sencillo es el
compostaje, el cual aumenta la fertilidad del suelo permitiendo que
microorganismos del suelo descompongan residuos orgánicos. Otras aplicaciones
incluyen la producción y uso de vacunas para prevenir enfermedades humanas y
animales. En la industria alimenticia, la producción de vino y de cerveza se
encuentra entre los muchos usos prácticos de la biotecnología.
La biotecnología moderna está compuesta
por una variedad de técnicas derivadas de la investigación en biología celular
y molecular, las cuales pueden ser utilizadas en cualquier industria que
utilice microorganismos o células vegetales y animales. Esta tecnología permite
la transformación de la agricultura. También tiene importancia para otras
industrias basadas en el carbono, como energía, productos químicos y
farmacéuticos y manejo de residuos o desechos.
Una definición
más exacta y específica de la biotecnología "moderna" es "la
aplicación comercial de organismos vivos o sus productos, la cual involucra
la manipulación deliberada de sus moléculas de DNA".
Esta definición implica una serie de desarrollos en técnicas de laboratorio
que, durante las últimas décadas, han sido responsables del tremendo interés
científico y comercial en biotecnología, la creación de nuevas empresas
y la reorientación de
investigaciones y de inversiones en compañías ya
establecidas y en Universidades.
v
TRANSFERENCIA
ACTIVIDAD # 4
1.
De
acuerdo a lo anteriormente expuesto, Explica con tus palabras qué es biotecnología y responde: ¿crees que la
biotecnología podría ser una herramienta importante en este periodo de
pandemia? ¿Por qué?
2.
Realiza
una línea de tiempo a cerca de la historia de la biotecnología.
3. Realiza una infografía a
cerca de una de las técnicas utilizadas en la Biotecnología moderna. Luego Realiza un vídeo exponiendo tu trabajo y el
punto siguiente.
4.
Investiga
cómo se creó la vacuna contra el Covid-19 y que técnica de biotecnología se
utilizó.
5.
Elabora
una sopa de letras con las palabras que más te llamaron la atención del texto.
Nota: una vez finalizado
el periodo te estaré enviando el link para la autoevaluación en línea.
Déjame
tu comentario acerca del trabajo de primer periodo, como te parecieron las
guías y que aprendiste:
GUIA # 2 PERIODO 1
|
GUÍA DE APRENDIZAJE N° 2 –
PRIMER PERIODO |
|
|
Área: Ciencias Naturales
Asignatura: Química
Grado: 10 Año: 2021 Docente: María Angélica Trespalacio Grupos: 10-01, 10-02,
10-03, 10-04 Fecha de Inicio: Marzo 01 de 2021
Fecha Máxima de devolución: Marzo 19 de 2021 |
|
|
Medio
de entrega |
Deben enviar
las fotos de las actividades y/o vídeos
al WhatsApp del docente de química. Docente: María
Angélica Trespalacio WhatsApp:
304 572 60 74 |
|
|
|
|
Tiempo |
Esta
guía está diseñada para que la realices en 3 semanas, dedicando 4 horas a la semana |
|
Instrucciones
para desarrollar la actividad |
Primero:
Dedica un tiempo mínimo de una hora cada semana a los saberes previos para su
asimilación. Segundo:
Dedica un tiempo mínimo de una hora cada semana a la estructuración para su
comprensión. Tercero:
Dedica
un tiempo mínimo de 2 horas semanalmente a la transferencia para su
desarrollo. Cuarto: Sí,
tienes dudas o inquietudes en la estructuración o en las actividades, consulta al docente comunicándote vía telefónica o
WhatsApp al 3045726074, email mtrespalacio21@hotmail.com o
comunicación semanal a través
de la clase virtual o video llamada. |
|
Recomendaciones |
Las actividades se deben realizar en el cuaderno de
química. Al comienzo de cada
actividad de transferencia debe tener el siguiente encabezado: Nombre completo del
estudiante, tema de la actividad, curso, periodo y nombre del docente al que
le envía. Si las actividades que envías no tienen el encabezado, la actividad
será devuelta. Enumera secuencialmente cada hoja de la actividad En los videos que
debas enviar debes de salir con el uniforme de diario de la institución |
|
Productos
a entregar por el estudiante |
Deben enviar
las fotos de las actividades y/o vídeos
al WhatsApp del docente de química. Docente: María
Angélica Trespalacio WhatsApp:
304 572 60 74 |
|
Hora
de comunicación semanal con el docente |
Docente: María Angélica Trespalacio Grupo 10-01
Viernes Hora: 7:00
A.M a 9:00 A.M Grupo 10-02 Viernes Hora: 10: 00 A.M a 12:00 A.. Grupo 10-03 Jueves Hora: 7:00 A.M a 9:00 A.M Grupo 10-04 Lunes Hora:
7:00 A.M a 9:00 A.M |
Metodología: A continuación encontrarás la guía # 2 de Química, del primer periodo, correspondiente al trabajo de 3 semanas. Para desarrollar las actividades propuestas, te recomiendo leer bien el contenido de la guía en cada tema y responder en tu cuaderno las preguntas planteadas. A demás, debes marcar la hoja del encabezado de la guía en tu cuaderno, con tu nombre completo, grado, fecha, número de la guía, tema y nombre del docente. Las siguientes hojas deben ir con tu nombre y grado.
Una vez realizadas las actividades en tu cuaderno, toma las fotos y en caso que se solicite un vídeo, este debe presentarse con el uniforme de diario, envíalas al WhatsApp 304 572 60 74 o al correo e-mail maantrespalacioromero@inseya.edu.co.
Primera Semana: Tema: CLASES DE MATERIA
Aprenderás…
La materia: las clases de materia.
v Clases
de materia
La materia puede presentarse como una sustancia pura o como una mezcla.
v
Las sustancias puras
Una sustancia
pura es aquella compuesta por un solo tipo de materia, presenta una composición
fija y se puede caracterizar por una serie de propiedades específicas. Por
ejemplo, al analizar una muestra pura de sal común siempre encontramos los
mismos valores para propiedades tales como la solubilidad (36 g/100 cm3 a 20
°C), la densidad (2,16 g/cm3) y el punto de fusión (801 °C). Los valores de las
propiedades específicas de las sustancias puras siempre son los mismos. Las
sustancias puras no pueden separarse en sus componentes por métodos físicos.
Según la
composición química, las sustancias puras se clasifican en: sustancias
simples o elementos químicos, y sustancias compuestas o compuestos
químicos.
v
Elemento químico
Un elemento químico es una sustancia
pura, que no puede descomponerse en otras más sencillas que ella. El hierro, el
oro y el oxígeno son ejemplos de elementos químicos, ya que no pueden
descomponerse en otras sustancias diferentes a ellos. Los elementos químicos se
representan mediante símbolos. Los símbolos siempre empiezan con una letra
mayúscula. En algunos casos el símbolo corresponde a la letra inicial del
nombre del elemento, por ejemplo, carbono (C) y oxígeno (O). En otros casos, se
simboliza con la letra inicial del elemento en mayúscula, seguida por una
segunda letra del nombre que siempre es minúscula, por ejemplo, cesio (Cs) y
magnesio (Mg).
Veamos que tantos
elementos conoces…
1. En
la siguiente tabla vas a poner los nombres y los símbolos de los elementos q te
sepas, ojo ¡solo si te los sabes!
|
Nombre del elemento |
Símbolo |
Nombre del elemento |
Símbolo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v Compuesto químico
Un compuesto químico es una sustancia pura, formada por la
combinación química de dos o más elementos, en proporciones definidas Por ejemplo,
1 g de cloruro de sodio siempre
contiene 0,3934 g de sodio y
0,6066 g de cloro, combinados químicamente. Los compuestos se representan por
medio de fórmulas. Una fórmula
química muestra los símbolos de los elementos que forman el compuesto, y la proporción
que existe entre ellos, es decir, señalan su composición química. Por ejemplo, la fórmula
del agua es H2O, lo que indica que esta sustancia está formada por hidrógeno y
oxígeno en una proporción de 2:1.
Los compuestos se
pueden clasificar en dos grandes grupos:
■ Los compuestos
orgánicos: son aquellos que tienen al carbono como
elemento principal combinado con elementos como el hidrógeno, oxígeno y
nitrógeno. Los carbohidratos, los lípidos
y las proteínas son ejemplos de compuestos orgánicos.
■ Los compuestos
inorgánicos: son aquellos que no tienen al carbono
como elemento principal. El agua (H2O) y el cloruro de sodio (NaCl) son
ejemplos de compuestos inorgánicos.
1.
Para los siguientes
compuestos, identifique los elementos que los componen y nombra si son compuestos orgánicos o inorgánicos.
|
Compuesto |
Elementos que lo componen |
Tipo de compuesto |
|
Agua (H2O) |
|
|
|
Vinagre (CH3 COOH) |
|
|
|
Óxido Férrico (Fe2 O3) |
|
|
v Las mezclas
Las mezclas son uniones físicas
de sustancias en las que la estructura de cada sustancia no cambia, por lo
cual sus propiedades químicas permanecen constantes y las proporciones pueden
variar. Además, es posible
separarlas por procesos
físicos. Por ejemplo,
la unión de agua con tierra es una
mezcla.
En una mezcla, la sustancia que se encuentra en mayor
proporción recibe el nombre de fase dispersante,
medio o solvente, y la sustancia que se encuentra en menor proporción
recibe el nombre de fase dispersa o
soluto. De acuerdo con la fuerza de cohesión entre las sustancias, el
tamaño de las partículas de la fase dispersa y la uniformidad en la
distribución de estas partículas las mezclas pueden ser homogéneas o heterogéneas.
Mezclas heterogéneas
son aquellas mezclas en las que la fuerza de cohesión
entre las sustancias es menor; las partículas de la fase dispersa son más
grandes que en las soluciones y dichas partículas no se encuentran distribuidas
de manera uniforme.
Mezclas homogéneas son aquellas mezclas que poseen la máxima fuerza de cohesión entre las
sustancias combinadas; las partículas de la fase dispersa son más pequeñas, y
dichas partículas se encuentran distribuidas uniformemente.
Métodos
de separación de mezclas
v Transferencia
Actividad # 1
3. Indica si las siguientes afirmaciones son verdaderas o
falsas. Explica todas tus respuestas.
__Todas las disoluciones son mezclas.
__Todas las mezclas son disoluciones.
__Todas las sustancias puras son homogéneas.
__Ninguna mezcla presenta un aspecto homogéneo.
4. Clasifica las siguientes sustancias en sustancias puras,
mezclas homogéneas y mezclas heterogéneas: mayonesa, madera, salsa de tomate,
cartón, cemento, jugo de naranja, agua marina, papel y granito.
5. Clasifica los
materiales que aparecen en el cuadro como: elemento, compuesto o mezcla.
6.
Segunda Semana: Tema: ESTRUCTURA ATOMICA: TEORÍAS ATÓMICAS
Aprenderás… Las teorías atómicas Modelos atómicos
v Responde: ¿Qué ocurriría si
dividiéramos un trozo de materia muchas veces?¿Llegaríamos
hasta una parte indivisible o podríamos seguir dividiendo sin parar?
v El átomo: conceptos básicos
Desde el siglo V a. de C. la
humanidad ha escuchado hablar de átomos, como las partículas fundamentales de
la materia. Sin embargo, debido a que los átomos son tan pequeños, no es
posible verlos a simple vista, por esta razón, se han propuesto varios modelos
y teorías acerca de cómo son estas partículas fundamentales. Veamos.
v El átomo a través del tiempo
Los griegos fueron quienes por primera vez se
preocuparon por indagar sobre la constitución íntima de la materia, aunque
desde una perspectiva puramente teórica,
pues no creían en la importancia de la experimentación. Cerca del año 450 a. de
C., Leucipo y su discípulo, Demócrito, propusieron que la materia
estaba constituida por pequeñas partículas a las que llamaron átomos, palabra
que significa indivisible.
Los postulados del atomismo griego establecían
que:
■ Los átomos son sólidos.
■ Entre los átomos sólo existe el vacío.
■ Los átomos son indivisibles y eternos.
■ Los átomos de diferentes cuerpos difieren
entre sí por su forma, tamaño y distribución espacial.
■ Las propiedades de la materia varían según el
tipo de átomos y como estén agrupados.
El siguiente cuadro resume los principales modelos y sus
características:
v
MODELO ATÓMICO ACTUAL
El modelo de Bohr tenía algunas
limitaciones a la hora de explicar el comportamiento de los electrones, así que
siguió siendo estudiado y corregido por otros científicos, hasta llegar al
modelo atómico actual. Los físicos Arnold Sommerfeld, Louis de Broglie, Werner
Heisenberg y Erwin Schrödinger, propusieron teorías que fueron mejorando el
modelo atómico y diseñaron el modelo actual, también conocido como modelo mecánico- cuántico.
v Transferencia
Actividad # 2
Realiza una maqueta con el modelo
atómico que más te haya gustado, utiliza materiales del medio y crea tu maqueta,
utiliza tu creatividad y recursividad para este punto. Envía la
evidencia a través de una fotografía
o realiza un video explicando tu maqueta.
Tercera Semana: Tema: ESTRUCTURA
ATOMICA: PROPIEDADES DE LOS ÁTOMOS
Aprenderás… Las propiedades
de los átomos
Responde:
¿Conoces alguna propiedad de los
átomos?
¿Recuerda las
partículas atómicas? Nómbralas
¿Identificas a
plenitud las cargas eléctricas de las partículas atómicas?
v Algunas propiedades de los átomos
Hemos visto hasta ahora que el átomo se
compone de tres partículas subatómicas: el protón,
el electrón y el neutrón. Protones y neutrones se disponen en la región central dando lugar
al núcleo del átomo, mientras que los electrones giran alrededor de este
centro en regiones bien definidas.
Muchas de las propiedades físicas de los átomos, como masa, densidad o
capacidad radiactiva se relacionan con el núcleo. Por el contrario, del arreglo
de los electrones en la periferia del átomo dependen propiedades químicas, como
la capacidad para formar compuestos con átomos de otros elementos.
Al describir un elemento químico se
mencionan algunas de sus propiedades, entre las que se encuentra el número
atómico, el número de masa y la masa atómica. A continuación explicaremos cada
una de estas magnitudes.
Número
atómico (Z)
El número atómico indica el número de
protones presentes en el núcleo y se representan con la letra Z. Dado que la carga de un átomo es
nula, el número de protones debe ser igual al número de electrones, por lo que
Z también indica cuántos electrones posee un átomo.
Por ejemplo, el átomo de hidrógeno, el
más sencillo que se conoce, tiene un núcleo compuesto por un protón que es
neutralizado por un electrón orbitando alrededor. De esta manera su número atómico
es Z = 1.
Número de masa (A)
El número de masa o número másico se representa con la letra A y hace referencia al número de protones y neutrones presentes en el núcleo. La masa del átomo está
concentrada en el núcleo y corresponde a la suma de la masa de los protones y
los neutrones presentes, dado que la masa de los electrones es despreciable en
relación con la masa nuclear, el número másico también es un indicador
indirecto de la masa atómica.
Consideremos
el siguiente ejemplo: el elemento sodio contiene 11 protones y el
número de neutrones corresponde al
número de protones +1en su núcleo.
Esto significa que:
Z (número de protones) = 11
N (número de neutrones) = 11 +1= 12
Por lo tanto A (masa atómica)
= Z (número de protones) + N
(número de neutrones), es decir, A = Z + N, entonces,
A= 11 + 12 =23
A=23.
La masa atómica del sodio es 23.
De esta forma lo encontraras en la tabla periódica
Practiquemos lo
aprendido…
1. Con la ayuda de tu tabla
periódica, vas a seleccionar 5 elementos y vas a escribir como se te mostró en el
ejemplo anterior el número de masa (A) y
numero atómico (Z) e identifica cuantos
protones, electrones y neutrones tiene cada uno de ellos.
Isótopos
Son átomos de un
mismo elemento, cuyos núcleos tienen el mismo número de protones (número
atómico Z), pero difieren en el número de neutrones (número de masa A).
Átomo
de oxígeno (16, 17 y 18) 16 O 8 ,17 O8 ,18
O 8 Se observa que todos los átomos de O, tienen igual número atómico Z = 8.
Para el caso del Átomo de carbono (12,
13 y 14) 12 C6, 13 C6, 14 C6; tienen Z= 6}
Isóbaros
Existen átomos de elementos diferentes, con características propias,
que poseen isótopos
con el mismo número de masa
(A). A estos elementos se les da el nombre de Isóbaros y son comunes en elementos radiactivos. Como ejemplos podemos
nombrar: calcio y argón, hierro y cobalto, estaño y telurio.
40 Ca20,
40 Ar 18 Se observa que los átomos o elementos de Ca
y Ar tienen igual número de masa (A =
40), pero diferente numero atómico (Z, Ca= 20 y Ar = 18).
57 Fe 26,
57 Co 27
122 Sn 50,
122 Te 52
v El átomo: conceptos básicos
Desde el siglo V a. de C. la
humanidad ha escuchado hablar de átomos, como las partículas fundamentales de
la materia. Sin embargo, debido a que los átomos son tan pequeños, no es
posible verlos a simple vista, por esta razón, se han propuesto varios modelos
y teorías acerca de cómo son estas partículas fundamentales. Veamos.
v El átomo a través del tiempo
Los griegos fueron quienes por primera vez se
preocuparon por indagar sobre la constitución íntima de la materia, aunque
desde una perspectiva puramente teórica,
pues no creían en la importancia de la experimentación. Cerca del año 450 a. de
C., Leucipo y su discípulo, Demócrito, propusieron que la materia
estaba constituida por pequeñas partículas a las que llamaron átomos, palabra
que significa indivisible.
Los postulados del atomismo griego establecían
que:
■ Los átomos son sólidos.
■ Entre los átomos sólo existe el vacío.
■ Los átomos son indivisibles y eternos.
■ Los átomos de diferentes cuerpos difieren
entre sí por su forma, tamaño y distribución espacial.
■ Las propiedades de la materia varían según el
tipo de átomos y como estén agrupados.
El siguiente cuadro resume los principales modelos y sus
características:
v
MODELO ATÓMICO ACTUAL
El modelo de Bohr tenía algunas
limitaciones a la hora de explicar el comportamiento de los electrones, así que
siguió siendo estudiado y corregido por otros científicos, hasta llegar al
modelo atómico actual. Los físicos Arnold Sommerfeld, Louis de Broglie, Werner
Heisenberg y Erwin Schrödinger, propusieron teorías que fueron mejorando el
modelo atómico y diseñaron el modelo actual, también conocido como modelo mecánico- cuántico.
v Transferencia
Actividad # 2
Realiza una maqueta con el modelo
atómico que más te haya gustado, utiliza materiales del medio y crea tu maqueta,
utiliza tu creatividad y recursividad para este punto. Envía la
evidencia a través de una fotografía
o realiza un video explicando tu maqueta.
Aprenderás… Las propiedades de los átomos
Responde:
v Algunas propiedades de los átomos
Hemos visto hasta ahora que el átomo se
compone de tres partículas subatómicas: el protón,
el electrón y el neutrón. Protones y neutrones se disponen en la región central dando lugar
al núcleo del átomo, mientras que los electrones giran alrededor de este
centro en regiones bien definidas.
Muchas de las propiedades físicas de los átomos, como masa, densidad o
capacidad radiactiva se relacionan con el núcleo. Por el contrario, del arreglo
de los electrones en la periferia del átomo dependen propiedades químicas, como
la capacidad para formar compuestos con átomos de otros elementos.
Al describir un elemento químico se
mencionan algunas de sus propiedades, entre las que se encuentra el número
atómico, el número de masa y la masa atómica. A continuación explicaremos cada
una de estas magnitudes.
Número
atómico (Z)
El número atómico indica el número de protones presentes en el núcleo y se representan con la letra Z. Dado que la carga de un átomo es nula, el número de protones debe ser igual al número de electrones, por lo que Z también indica cuántos electrones posee un átomo.
Por ejemplo, el átomo de hidrógeno, el más sencillo que se conoce, tiene un núcleo compuesto por un protón que es neutralizado por un electrón orbitando alrededor. De esta manera su número atómico es Z = 1.
El número de masa o número másico se representa con la letra A y hace referencia al número de protones y neutrones presentes en el núcleo. La masa del átomo está concentrada en el núcleo y corresponde a la suma de la masa de los protones y los neutrones presentes, dado que la masa de los electrones es despreciable en relación con la masa nuclear, el número másico también es un indicador indirecto de la masa atómica.
Esto significa que:
Z (número de protones) = 11
N (número de neutrones) = 11 +1= 12
Por lo tanto A (masa atómica) = Z (número de protones) + N (número de neutrones), es decir, A = Z + N, entonces,
A= 11 + 12 =23
A=23.
La masa atómica del sodio es 23.
De esta forma lo encontraras en la tabla periódica
Practiquemos lo aprendido…
Isótopos
Son átomos de un mismo elemento, cuyos núcleos tienen el mismo número de protones (número atómico Z), pero difieren en el número de neutrones (número de masa A).
Átomo de oxígeno (16, 17 y 18) 16 O 8 ,17 O8 ,18 O 8 Se observa que todos los átomos de O, tienen igual número atómico Z = 8.
Para el caso del Átomo de carbono (12, 13 y 14) 12 C6, 13 C6, 14 C6; tienen Z= 6}
Isóbaros
Existen átomos de elementos diferentes, con características propias, que poseen isótopos con el mismo número de masa (A). A estos elementos se les da el nombre de Isóbaros y son comunes en elementos radiactivos. Como ejemplos podemos nombrar: calcio y argón, hierro y cobalto, estaño y telurio.
40 Ca20, 40 Ar 18 Se observa que los átomos o elementos de Ca y Ar tienen igual número de masa (A = 40), pero diferente numero atómico (Z, Ca= 20 y Ar = 18).
57 Fe 26,
57 Co 27
122 Sn 50,
122 Te 52
v Ejemplos:
Hallar el
número de electrones, protones y neutrones en los isótopos de los siguientes elementos:
a) 84 Kr 36 b) 92 U 238
Desarrollo
a)
Como Z =36,
se tienen 36 protones y 36 electrones.
Número
de masa (A) = 84 y como A = Z + N, entonces, despejamos a N, N =
A - Z, remplazando tenemos que N
= 84 – 36, Entonces N = 48.
Entonces el Kriptón (Kr) tiene 36 protones, 36
electrones y 48 neutrones
b) De la misma forma como resolvimos el punto anterior: Z = 92, A = 238, por lo tanto, N = 238- 92 = 146, de donde concluimos que el uranio tiene 146 neutrones, 92 protones y 92 electrones.
v Transferencia
Actividad # 3
1. Con la ayuda de tu tabla
periódica, vas a seleccionar 10
elementos diferentes a los ya utilizados y vas a escribir como se te mostró en ejemplos anteriores el número
de masa y numero atómico e identifica cuantos protones, electrones y neutrones
tiene cada uno de ellos.
2.
De los siguientes átomos clasifica en cada casilla
cuales con isotopos y cuales son isobaros
v Evaluación
1. La
materia puede clasificarse analizando su composición como se muestra
en el diagrama.
El acero es un material que contiene los elementos hierro y
carbono. Dos muestras distintas de acero tienen diferentes cantidades de estos
elementos pero ambas muestras tienen composición uniforme. Usando el diagrama
anterior, ¿cómo clasificaría al acero?
A.
Como mezcla homogénea, porque está formado por
diferentes elementos y es uniforme.
B.
Como sustancia pura, porque tiene composición
uniforme y es un solo compuesto.
C.
Como mezcla heterogénea, porque está formado por
diferentes elementos.
D.
Como sustancia pura, porque muestras distintas
tienen composición diferente.
2. Una
estudiante quiere clasificar dos sustancias de acuerdo al tipo de mezclas que
son. Al buscar, encuentra que las mezclas homogéneas son uniformes en todas sus
partes, pero las mezclas heterogéneas no lo son. La estudiante realiza
los procedimientos que se muestran
en la tabla con las sustancias 1 y 2.
A.
Una unidad indestructible.
B.
La partícula más pequeña de la que está hecha la materia.
C.
Partículas sólidas de elementos combinados.
D. Porciones pequeñas de materia.
4. La teoría atómica se refiere a:
A.
Diversas concepciones que se han tenido acerca de
los elementos y su constitución.
B.
Al modelo planetario.
C.
Diversas concepciones que se han tenido acerca de
las moléculas y su constitución.
D.
Diversas concepciones que se han tenido acerca del
átomo y su constitución.
5. Un elemento tiene un número de masa atómica de 65 y se determinó que presenta 35 neutrones en su núcleo. Teniendo en cuenta esta información, que el átomo es neutro y que esta se puede expresar mediante una ecuación el número de electrones que tiene este elemento:
A.
35
B.
30
C. 65
D. 100
Responde las
preguntas 6 y 7 de acuerdo a la siguiente información:
Cuando se calienta
la sustancia X se producen
dos nuevos materiales sólidos Y y W. Cuando Y y W se someten separadamente a
calentamiento, no se producen materiales más sencillos que ellos. Después de
varios análisis, se determina que el sólido W es muy soluble en agua, mientras
que Y es insoluble.
6. De acuerdo con lo
anterior, el material X probablemente es
A.
una solución
B.
un elemento
C.
un compuesto
D.
una mezcla heterogénea
7. Después
de descomponer la sustancia X, se requiere obtener por separado el material W,
para ello es necesario
A.
destilar
B.
disolver en agua
C. decantar
D. evaporar.
|
|
A |
B |
C |
D |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
=======================================================================================
|
Área: Ciencias Naturales |
Grado: Decimo |
|
Docente |
Lic. María Angélica Trespalacio |
|
Estándares |
Establecer relaciones entre las características
macroscópicas y microscópicas de la materia y las propiedades físicas y
químicas de las sustancias que la constituyen. |
|
Derechos
básicos de Aprendizaje |
Comprende
la clasificación de los materiales a partir de grupos de sustancias (elementos
y compuestos) y mezclas (homogéneas y heterogéneas). |
|
Temática: |
Semana
1: La química: generalidades Semana
2: La materia y sus propiedades Semana
3: Transformaciones de la materia. |
|
Curso:
Sexto 10°1- 10°2 - 10°3 - 10°4 |
Fecha
de entrega: |
|
Estudiante:
Grado: |
|
Metodología: A
continuación encontrarás la guía de Química, correspondiente al trabajo de 3
semanas del primer periodo. Para desarrollar las actividades propuestas, te
recomiendo leer bien el contenido de la guía en cada tema y responder en tu
cuaderno las preguntas planteadas. A demás, debes marcar cada hoja de tu
cuaderno, con tu nombre completo, grado, fecha, número de la guía, tema y
nombre del docente.
Una vez realizadas las actividades en tu cuaderno, toma las fotos y envíalas al WhatsApp 304 572 60 74 o al correo e-mail maantrespalacioromero@inseya.edu.co
TEMA #1: La química: generalidades
INTRODUCCIÓN A LA QUÍMICA
Desde la Antigüedad el hombre ha intentado entender por qué y cómo se producen los fenómenos naturales que observa a su alrededor. Este anhelo de comprensión ha dado origen a diversas corrientes de pensamiento, como la religión, el arte o la ciencia. A continuación nos centraremos en una de las muchas ramas en las que está dividida la ciencia: la química. La química es una ciencia natural mediante la cual el hombre estudia la composición y el comportamiento de la materia, así como la relación de ésta con la energía. Pero, comprender los fenómenos naturales no solo le ha servido a la humanidad para satisfacer su curiosidad. También ha servido para mejorar la calidad de vida de las personas. Así, materiales como plásticos, pinturas o detergentes; medicamentos como la penicilina, los antiácidos o la insulina, y máquinas como los refrigeradores o los motores de combustión interna, han sido posibles gracias al creciente conocimiento que tenemos del mundo a nuestro alrededor y muy especialmente gracias a los avances alcanzados en la química.
La historia de la química abarca
un periodo de tiempo muy grande que va desde la prehistoria hasta el presente,
y está ligada al desarrollo del hombre y su conocimiento de la naturaleza. Las
civilizaciones antiguas ya usaban tecnologías que demostraban su conocimiento
de las transformaciones de la materia, y algunas servirían de base a los
primeros estudios de la química. Entre ellas se cuentan la extracción de los
metales de sus menas, la elaboración de aleaciones como el bronce, la
fabricación de cerámica, esmaltes y vidrio, la fermentación de la cerveza y el
vino, la extracción de sustancias de las plantas para usarlas como medicinas o
perfumes y la transformación de las grasas en jabón.
A base de realizar experimentos y
registrar sus resultados los alquimistas establecieron los cimientos de la
química moderna. El punto de inflexión se produjo con la obra de 1661, The
Sceptical Chymist (El químico escéptico) de Robert Boyle, donde separó
claramente la química de la alquimia, y en adelante la química aplicaría el método científico en sus experimentos.
Se considera que la química alcanzó el rango de ciencia de pleno derecho con
las investigaciones de Antoine Lavoisier, en las que basó su ley de
conservación de la materia, entre otros avances que asentaron los pilares
fundamentales de la química. A partir del siglo XVIII la química adquiere
definitivamente las características de una ciencia experimental moderna. Se
desarrollaron métodos de medición más precisos que permitieron un mejor
conocimiento de los fenómenos y se desterraron creencias no demostradas. La
historia de la química se entrelaza con la historia de la física, como en la
teoría atómica, y en particular con la termodinámica desde sus inicios con el
propio Lavoisier, y especialmente a través de la obra de Willard Gibbs.
ACTIVIDAD #1
1. Consulta
en un texto o en internet acerca de la historia de la química y elabora una línea de tiempo de cómo evolucionó la química a través de la historia.
2.
El desarrollo de la química le ha brindado
al ser humano avances muy importantes en el ámbito científico y tecnológico.
Sin embargo, algunos de estos aportes han sido utilizados con fines
destructivos o han perjudicado el equilibrio del planeta. Menciona diez aportes de la química que hayan mejorado tu calidad de
vida y diez que la estén afectando.
3.
La química también ha servido para mejorar
la calidad de vida de las personas. Así, han permitido la creación de
materiales como plásticos, pinturas o detergentes y medicamentos como la
penicilina, los antiácidos o la insulina.
¿Cuáles son las ventajas y cuáles las desventajas de la obtención de estos
productos?
4.
Consulta
acerca de los diferentes campos de acción de la química en nuestro país.
TEMA #2: La
materia y sus propiedades.
Como recordarás, materia es todo lo que nos rodea, es
todo aquello que tiene masa y ocupa un lugar en el espacio. La química es la
ciencia que estudia la materia, sus propiedades, su constitución cualitativa y
cuantitativa, los cambios que experimenta, así como las variaciones de energía
que acompañan a las transformaciones en las que interviene.
PROPIEDADES DE LA MATERIA
1.
Propiedades generales o extrínsecas
Las propiedades generales son
las propiedades comunes a toda clase de materia; es decir, no nos proporcionan
información acerca de la forma como una sustancia se comporta y se distingue de
las demás. Las propiedades generales más importantes son:
■
Masa, cantidad de materia que tiene
un cuerpo.
■ Volumen, espacio que ocupa un cuerpo.
■
Peso, resultado de la fuerza de
atracción o gravedad que ejerce la Tierra sobre
los cuerpos.
■ Inercia, tendencia de un cuerpo a permanecer
en estado de movimiento o de reposo mientras no exista una causa que la
modifique y se relaciona con la cantidad de materia que posee el cuerpo.
■
Impenetrabilidad, característica por la cual un cuerpo no puede ocupar el espacio que
ocupa otro cuerpo al mismo tiempo.
■
Porosidad, es la característica
de la materia que consiste en presentar poros o espacios vacíos.
2.
Propiedades
específicas o intrínsecas
Las propiedades intrínsecas
son las mismas propiedades específicas y como su nombre lo indica, estas
permiten identificar y diferenciar unas sustancias de otras. Estas propiedades
son muy importantes. Proveen información sobre las características puntuales de
todas las sustancias. Estas propiedades a su vez, se clasifican en propiedades físicas y químicas.
·
Las
propiedades físicas son independientes a la cantidad de sustancia y no
cambian la naturaleza de las sustancias. Algunas de ellas son: organolépticas,
densidad, punto de ebullición, punto de fusión, solubilidad, conductividad,
ductilidad, maleabilidad y dureza, entre otras.
Las propiedades organolépticas son aquellas que perciben nuestros
sentidos, como el color, el olor, la textura, el sabor, etc.
La densidad es la relación que existe entre la masa de una
sustancia y su volumen.
El punto de ebullición, es la temperatura a la cual una sustancia
pasa de estado líquido a estado gaseoso. Por ejemplo, el punto de ebullición
del agua es de 100 °C.
El punto de fusión es la temperatura a la cual una sustancia pasa
de estado sólido a estado líquido. Por ejemplo, el punto de fusión del cobre es
de 1.085 °C.
La solubilidad se define como la propiedad que tienen algunas
sustancias para disolverse en un líquido formando una solución a una
temperatura determinada. Por ejemplo, el esmalte es insoluble en agua pero es
soluble en acetona.
La conductividad es la propiedad que se genera por la interacción
de los materiales con la electricidad y el calor. Por ejemplo, la cerámica
transfiere el calor y los metales la electricidad.
La ductilidad hace referencia a la facilidad con la cual algunos
materiales se dejan convertir en hilos o alambres como el cobre, la plata y el
oro.
La maleabilidad es la capacidad que tienen algunos materiales de
convertirse en láminas. Por ejemplo, metales como cobre, oro, plata y aluminio.
La dureza es la resistencia que oponen las sustancias a ser rayadas.
Se mide con la escala llamada Mohs y cuyo rango es de 1 hasta 10. Por ejemplo,
el talco tiene una dureza de 1, mientras que el diamante presenta una dureza de
10, siendo éste último, el material más duro que se encuentra en la naturaleza.
·
Las
propiedades químicas describen el comportamiento que tienen las sustancias
cuando interactúan con otras. Cuando determinamos una propiedad química, las
sustancias cambian su estructura y composición. Algunas propiedades químicas
son: la oxidación, la combustión, la inestabilidad, la corrosión,
descomposición en presencia de luz, reactividad con agua, entre otras.
La oxidación es la propiedad que sufren algunos materiales cuando
se combinan con el oxígeno del aire o el agua. Por ejemplo, un trozo de sodio
metálico expuesto al aire.
La combustión es un proceso de oxidación rápida en presencia de
oxígeno, en el cual existe desprendimiento de energía en forma de luz y calor.
Por ejemplo, la que ocurre con el gas propano.
La inestabilidad es la propiedad que sufren algunas sustancias al
descomponerse.
La corrosión es el deterioro que sufre el material en un ambiente
húmedo propio del entorno como el aire o el agua. Por ejemplo, una estatua en
medio de un parque.
ACTIVIDAD #2
1.
En cualquier lugar podemos detectar la
presencia de la química. Escribe una
lista de 10 sustancias químicas diferentes que encuentres en tu casa. Ahora con
esas sustancias completa la siguiente tabla, guíate por el ejemplo:
|
Nombre de la Sustancia |
Estado en que se encuentra |
Propiedades organolépticas que puedes
observar |
|
Azúcar |
Sólido |
Sabor, olor, color, textura |
1.
Elabora un mapa conceptual a cerca de la
materia y sus propiedades, con los conceptos dados en el texto anterior.
2.
Indaga acerca del estado plasma y
superfluido. Elabora un resumen de sus características y propiedades.
3.
A partir de la lectura “la materia y sus
propiedades” completa el crucigrama, verificando conceptos relacionados con las
propiedades de la materia.
Horizontales 3.
Facilidad con la que algunos materiales se dejan convertir en hilos o alambres. 6.
Temperatura a la cual una sustancia pasa de estado sólido a estado líquido. 7. Deterioro que sufre un material en un ambiente húmedo propio del
entorno. 8. Propiedad que sufren algunas sustancias al descomponerse. 11. Tendencia de un cuerpo a permanecer en estado de reposo o en
movimiento si no existe una fuerza que haga cambiar dicha condición. 12. Espacio que ocupa un cuerpo. 15. Temperatura a la cual una sustancia pasa de estado líquido a estado
gaseoso. 18. Característica por la cual un cuerpo no puede ocupar el espacio de
otro al mismo tiempo. 19. Relación que existe entre la masa de una sustancia y su volumen. |
Verticales 1.
Aquellas propiedades que se perciben con nuestros sentidos. 2.
Propiedad que sufren algunos materiales cuando se combinan con el oxígeno del
aire. 4.
Proceso de oxidación (presencia de oxígeno) rápida, en el cual se presenta
desprendimiento de energía en forma de luz y calor. 5.
Propiedad que permite identificar y diferenciar unas sustancias de otras. 9.
Propiedad que se genera por la interacción de los materiales con la
electricidad y el calor. 10. Fuerza con la que la gravedad atrae un cuerpo hacia el centro de la
Tierra. 13. Propiedad que tienen algunas sustancias para disolverse en un líquido
formando una solución a una temperatura determinada. 14. Capacidad que tienen algunos materiales de convertirse en láminas. 16. Resistencia que oponen las sustancias a ser rayadas. |
TRANSFORMACIONES FÍSICAS
Son aquellas transformaciones
o cambios que no afectan la composición
de la materia. En los cambios físicos no se forman nuevas sustancias. Se
dan cambios físicos cuando ocurren fenómenos como los siguientes: el aroma de
un perfume se esparce por la habitación al abrir el frasco que lo contiene; al
añadir azúcar al agua, el azúcar se disuelve en ella. En estos ejemplos, el
perfume se evapora y el azúcar se disuelve. Cada una de estas transformaciones
se produce sin que cambie la identidad de las sustancias; sólo cambian algunas
de sus propiedades físicas por lo que se dice que ha sucedido una
transformación física. También son cambios físicos, los cambios de estado, porque no se altera la composición o naturaleza
de la sustancia. Los cambios de estado dependen de las variaciones en las
fuerzas de cohesión y de repulsión entre las partículas. Cuando se modifica la
presión o la temperatura, la materia pasa de un estado a otro. Veamos.
■
Al aumentar la presión, las
partículas de materia se acercan y aumenta la
fuerza de cohesión entre ellas. Por ejemplo, un
gas se puede transformar en líquido si se somete a altas presiones.
■ Al aumentar la temperatura, las partículas de materia se mueven más rápido y, por tanto, aumenta la fuerza de repulsión entre ellas. Por ejemplo, si se calienta un líquido, pasa a estado gaseoso.
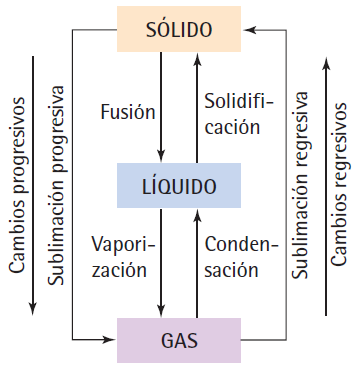
Fusión:
es el paso del estado sólido al estado líquido.
Solidificación: es el proceso inverso a la fusión,
es decir, es el cambio del estado líquido al estado sólido.
Vaporización: es el paso de líquido a gas por acción del calor.
Condensación: es el proceso inverso a la evaporación, es decir, es el cambio de gas a líquido.
Sublimación progresiva: es el paso del estado sólido al estado gaseoso sin pasar por el estado líquido.
Sublimación regresiva: es el proceso inverso a la sublimación
progresiva. Del estado gaseoso se pasa al estado sólido al bajar la
temperatura.
TRANSFORMACIONES
QUÍMICAS
Son aquellas
transformaciones o cambios que afectan la composición de la materia. En los
cambios químicos se forman nuevas sustancias. Por ejemplo cuando ocurren
fenómenos como los siguientes: un papel arde en presencia de aire (combustión)
y un metal se oxida en presencia de aire o agua (corrosión), podemos decir que
cambió el tipo de sustancia, convirtiéndose en otra diferente: por eso se dice
que se produjo una transformación química.
En las
transformaciones químicas se producen reacciones químicas. Una reacción
química se da cuando dos o más sustancias entran en contacto para formar otras
sustancias diferentes. Es posible detectar cuándo se está produciendo una
reacción química porque observamos cambios de temperatura, desprendimiento de
gases, etc.
ACTIVIDAD #3
1. Determina
cuáles de los siguientes cambios son
físicos y cuáles son químicos, y explica por qué:
a) Quemar papel
b) Limpiar los objetos de plata
c) Hacer hielo en el congelador
d) Hervir agua
e) Fundir hierro.
2. Escribe
V, si el enunciado es verdadero o F, si es falso.
___El punto de fusión es una propiedad química de la
materia.
___La sublimación es un cambio físico.
___Las propiedades físicas no involucran cambios en la
composición y la estructura de la materia.
___La combustión del papel se considera como una
propiedad física.
___La densidad y la masa son propiedades físicas.
___Para producir la condensación es necesario un aumento
de temperatura.
___Los cambios de la materia se consideran propiedades
químicas.
___ Si tenemos vapor de agua y queremos obtener hielo,
debemos llevar a cabo los procesos de fusión y solidificación.
3. En la siguiente tabla señala con una ✗ cuáles procesos son cambios físicos y cuáles son cambios químicos. Argumenta tu respuesta
a) ¿Cómo varía la densidad del vino respecto al tiempo de elaboración?
b) ¿Qué densidad en g/mL presenta el vino cuando han
transcurrido 18 días?
c) ¿Cómo influye la densidad del vino en sus cualidades
organolépticas?
Analiza la siguiente gráfica.
Responde:
a) Entre los puntos c y d, ¿cómo se encuentra la
materia?
b) Entre los puntos d y c, ¿qué cambio de estado
ocurre?
c) ¿Cómo se encuentra la materia en el punto f?
d) ¿Qué relación existe entre los cambios de estado y
la temperatura?

























Comentarios
Publicar un comentario